Qualche approfondimento sul ciclo del carbonio
Quanto carbonio si trova in atmosfera sotto forma di CO2? Quanto se ne è aggiunto negli ultimi 250 anni? E nel mare? Sembrano domande difficili e lo sono certamente, ma può risultare una scoperta capire che grazie a semplici modellazioni e a semplici calcoli, che usano niente più che la geometria e la chimica del liceo, è possibile dare una risposta, sia pure approssimata.
.
 Vediamo come si può fare qualche semplice conto .
Vediamo come si può fare qualche semplice conto .
Anzitutto quanto pesa l’atmosfera terrestre? Noi sappiamo che esercita al livello del mare una pressione di 1 atmosfera per cm2, ossia l’equivalente di circa 1kg/cm2 o di 10 ton/m2; su questa base possiamo facilmente calcolarlo. La pressione che esercita dipende appunto dal suo peso e se calcoliamo la superficie terrestre totale e la moltiplichiamo per questo peso unitario abbiamo una prima risposta.
Raggio terrestre=6.371 km
Area in km2, considerando la Terra come una sfera = 4pr2 = 4 x 3,14 x 6.3712 = 510 milioni di km2 circa.
Dato che un km2 è un milione di m2 abbiamo quindi 5,1 x 1014 m2. Su questa superficie si esercita una forza di 5,1 x 1015 ton che è il peso dell’atmosfera: 5,1 milioni di miliardi di ton o 5,1 peta-tonnellate.
Come sappiamo dalle misure di Mauna Loa, la CO2 rappresenta 390 ppm in volume (dicembre 2010); e questa, per la legge dei gas, è anche la percentuale sulla pressione, ma in peso?
Consideriamo che il peso molecolare medio dell’aria è di 28,97, ossia 28,97 g/mole; la CO2 pesa 44,01, o 44,01g/mole e di conseguenza la sua percentuale in peso sarà più elevata di quella in volume, nella medesima proporzione: ossia 390 x 44,01/28,97=590 ppm in peso.
Ne segue comunque che il peso della CO2 è in totale 5,1 x 1015 x 590/1.000.000 ton, ossia circa 3.009 Gton. Attualmente (1).
.
Al principio della rivoluzione industriale (attorno al 1750) erano invece 278 ppm in volume (dati NOAA) ed in peso 278 x 44,01/28,97 = 422 ppm in peso. Immaginando che l’atmosfera fosse la medesima globalmente, arriviamo a 5,1 x 1015 x 422/1.000.000 ton = 2.153 Gton.
Allora possiamo concluderne che la quantità totale si è accresciuta di circa 856 Gton. Questa è la quantità rimasta in atmosfera, ma quanta CO2 è stata riversata nell’atmosfera dalle nostre attività?
.
 Dai dati statistici della CDIAC che ha pazientemente sommato tutti i consumi storici di combustibili fossili e le quantità di carbonato distrutte nella produzione di cemento, si apprende che abbiamo emesso dal 1751 ben 337 Gton di carbonio per il consumo di combustibili fossili e la produzione di cemento; per capire quanta CO2 abbiamo così prodotto, occorre moltiplicare questo numero per il rapporto fra il peso molecolare della CO2 e quello del carbonio, ossia 44,01/12,011; quindi 337 x 44,01/12,011 = 1.235 Gton di CO2.
Dai dati statistici della CDIAC che ha pazientemente sommato tutti i consumi storici di combustibili fossili e le quantità di carbonato distrutte nella produzione di cemento, si apprende che abbiamo emesso dal 1751 ben 337 Gton di carbonio per il consumo di combustibili fossili e la produzione di cemento; per capire quanta CO2 abbiamo così prodotto, occorre moltiplicare questo numero per il rapporto fra il peso molecolare della CO2 e quello del carbonio, ossia 44,01/12,011; quindi 337 x 44,01/12,011 = 1.235 Gton di CO2.
A questo occorre aggiungere il carbonio emesso per l’uso della terra (deforestazione, agricoltura, etc.). Qui la stima è più complessa e soggetta a maggiori errori; comunque CDIAC stima almeno 150 Gton di carbonio dal 1850; quindi altre 150 x 44,01/12,011 = 550 Gton, una stima per difetto.
Siamo ad almeno 1.785 Gton di CO2 emesse dalle attività umane negli ultimi 250 anni.
Dato che ne sono rimaste in atmosfera 856, i pozzi abiotici e la biosfera ne hanno riassorbite 929 Gton, principalmente nel mare, che ne costituisce un formidabile deposito, decine di volte più grande dell’atmosfera. Il riassorbimento netto dalla biosintesi o nel suolo forestale o agricolo dobbiamo invece considerarlo negativo data la stima di perdita netta di CDIAC.
.
L’aggiunta di CO2 all’acqua del mare ne provoca l’acidificazione in quanto il gas in questione è un acido debole; in acqua forma infatti acido carbonico, H2CO3.
Teniamo presente che, per il medesimo motivo, l’interazione fra CO2 e mare non può essere stimata usando solo la legge di Henry, cioè l’equilibrio fra gas e soluzione, come per esempio per l’ossigeno o l’azoto; in soluzione acquosa la CO2 si trasforma in acido carbonico, ione bicarbonato e ione carbonato, a sua volta in equilibrio con un corpo di fondo di carbonato di calcio e di magnesio. Per capire meglio cosa succede esaminiamo il grafico seguente:
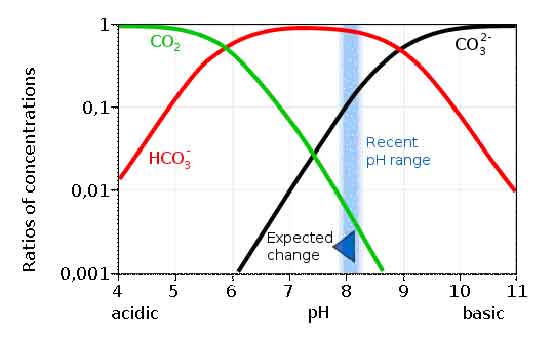
in cui è mostrato l’andamento della concentrazione delle tre principali specie chimiche discendenti dall’anidride carbonica in acqua. Si tenga presente che, per quanto riguarda la banda blù, il grafico è indicativo ed i valori indicati in esso non sono esattamente quelli calcolati. La banda blù esprime l’intervallo di variazione misurato nell’acidità del mare, che è valutata con l’unità definita come pH, ossia il log cambiato di segno della concentrazione dello ione H+. Il grafico è un grafico logaritmico: in ogni direzione uno spostamento verso sinistra o verso l’alto di una tacca segna un aumento di dieci volte e in direzione opposta una diminuzione di 10 volte, della concentrazione di H+ o della specie chimica considerata..
L’estremo destro della banda indica il valore iniziale, al 1750, circa 8,179, mentre l’estremo sinistro indica il valore odierno di 8,069 unità.
.
E’ importante capire cosa succede e perché. Aggiungere CO2 fa aumentare la sua concentrazione e fa aumentare anche la concentrazione di ione bicarbonato, mentre diminuisce quella dello ione carbonato; delle tre sostanze lo ione bicarbonato è dominante, mentre il secondo in abbondanza è il carbonato e solo ultima la CO2. La modifica in corso avvicina la concentrazione di CO2 e di carbonato; attualmente lo ione bicarbonato rappresenta circa il 90% del totale, lo ione carbonato un 9% e la CO2 circa 1%. Dato l’uso di una grandezza logaritmica come il pH la concentrazione di H+ è aumentata di circa il 29% sebbene la riduzione del pH sia di sole 0,11 unità: infatti il logaritmo decimale di 1,29 è appunto 0,11.
A quanto C complessivamente corrisponde in tutte e tre le forme questa modifica? Non è un calcolo stechiometrico difficile, ma lo effettuiamo usando un calcolatore su web, che tiene conto anche dell’effetto della salinità complessiva, della temperatura e della pressione. Dato che queste grandezze cambiano di continuo possiamo solo avere delle stime; useremo una pressione totale di 1 atm, una temperatura media dell’acqua di 15°C e la salinità media del mare.
Introducendo i due valori di pH nella prima casella della colonna centrale otteniamo nelle ultime tre caselle della medesima colonna le concentrazioni delle tre specie in mmol/litro (ossia millesimi di mole per litro):
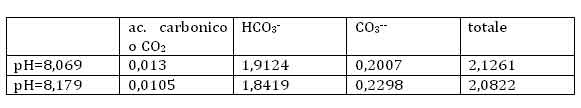
Possiamo innanzitutto valutare la quantità di C presente nel mare sotto forma di ione carbonato o bicarbonato o di anidride carbonica.
Il volume del mare è stimato in 1,35 miliardi di km3, che corrisponderebbe ad un cubo di oltre 1.100 km di lato o ad una sfera con un diametro di 1.370 km, ossia un vero e proprio “pianetino” di acqua, ben più grande del più grande dei pianetini, Cerere, il cui diametro è di soli 930 km; ricordiamo inoltre che 1 km3 è 1 miliardo di m3; quindi abbiamo 1,35 x 1018 m3.
.
Al principio dell’era industriale avevamo, nelle sue varie forme, un totale equivalente di CO2 di 2,0822 mmol/litro, ossia (moltiplicando per 1.000 numeratore e denominatore) moli/m3. Quindi 2,0822 x 44,01 g = 91,64 g di CO2 per m3 di acqua di mare; in totale 91,64 g/m3 x 1,35 x 1018 m3 = 123,7 x 1018 g = 123,7 x 1012 ton, ossia 123,7 Teraton, 123.700 Gton, una quantità oltre 57 volte maggiore che nell’atmosfera di allora!
La situazione è cambiata così: 2,1261 x 44,01= 93,57 g/m3 ; di conseguenza abbiamo un totale di 93,57 g/m3 x 1,35 x 1018 m3 = 126,3 x 1018 g = 126,3 x 1012 ton = 126.300 Gton, ossia 42 volte più che in atmosfera oggi.
In sostanza ad un aumento di pressione parziale della CO2 del 40% circa in atmosfera sarebbe corrisposto un aumento di gas disciolto come tale del 24% e solo del 4% dello ione bicarbonato, una riduzione dello ione carbonato del 15% e un incremento del totale delle varie forme del 2%.
La quantità di gas disciolta in più in ogni m3 di mare sarebbe tale che in totale avremmo 126.300 – 123.700= 2.600 Gton di CO2 in più.
La quantità di anidride carbonica necessaria a far variare il pH del mare nella sua totalità è oltre il doppio di quella che ci abbiamo rilasciata, stando ai dati CDIAC, come si spiega questo disaccordo?
Certamente dipende in parte dalla difficoltà di stimare valori “medi” accettabili delle varie grandezze. Ma una differenza altrettanto importante la fanno i meccanismi di trasporto dei gas nell’oceano; in sostanza il mare non è una soluzione in equilibrio con l’atmosfera (il trasporto è non solo diffusione, ma anche correnti oceaniche e moti convettivi su scala gigantesca, come il cosiddetto ”nastro trasportatore” o la caduta di detriti che vengono poi degradati ad una certa profondità).
L’anidride carbonica penetra velocemente nella parte superiore dell’oceano, modificandone velocemente il pH, ma poi, più in basso dove vento e onde non ci sono il processo è molto più lento; quindi la variazione di pH stimata in superficie probabilmente non corrisponde a quella presente a maggiore profondità, dove fra l’altro la temperatura e la pressione sono diverse e di conseguenza la solubilità del gas è diversa.
.
Secondo le conoscenze attuali la distribuzione attuale della CO2 in oceano varia con la zona e con la profondità, mostrando una specie di massimo verso i 400-800 metri; inoltre essa ha oscillato in sincrono con le glaciazioni, ed è diminuita negli ultimi 30 milioni di anni.
Potremmo, in modo molto grossolano, stimare che grazie a questi complessi meccanismi di trasporto solo un volume di oceano pari a 929/2.600=0,36 , quindi il 36% circa è stato influenzato finora da questo meccanismo di acidificazione, una profondità corrispondente a circa il 36% di quella media del mare che è di circa 4.200 metri, ossia circa 1.500 metri.
Possiamo facilmente comprendere come nella realtà il volume influenzato potrebbe essere superiore se accettassimo che l’effetto diminuisca con la profondità. Possiamo aspettarci anche che con il tempo l’effetto aumenti incrementando anche le conseguenze biologiche del processo.
.
Testo di Claudio Della Volpe
.
(1) E’ interessante notare che l’incremento percentuale della CO2 ha modificato il peso molecolare medio dell’aria, perché la CO2 pesa più della media degli altri gas. Il peso è cresciuto rispetto a quello riportato nella maggior parte dei libri, ma non è facile misurarlo, perché la variazione è sulla seconda decimale (per la precisione 28,98 rispetto a 28,96). Questo è un altro effetto dell’incremento della CO2 atmosferica; le percentuali riportate in questa pagina sono errate rispetto a quelle aggiornate di UIGI o di Wikipedia. Se fate una piccola ricerca, vedrete che è vero per molte altre pagine web e di libri: riportano ancora una concentrazione pre-industriale di CO2, generalmente indicata come 0,03% invece dello 0,0390%, con conseguenti variazioni anche delle altre. Ho usato un valore intermedio nei calcoli che comunque non vengono modificati in modo sostanziale.
12 responses so far
Su questo tema segnalo alcuni utili esercizi del progetto “Consumi amici del clima”
http://www.consumieclima.org/esercizi.html
in particolare i file excel dei moduli 2 e 3.
Magnifico.
Mi sembra utile questa valutazione quantitativa, approssimata ma facilmente comprensibile, delle fonti di carbonio, in particolare antropiche, e di dove va a finire, non solo nell’atmosfera ma anche nei mari di cui modifica l’acidità.
Per completare il quadro sarebbe utile approfondire quanto carbonio viene fissato dalla vegetazione attraverso la fotosintesi clorofilliana. E’ meno semplice di quanto sembri a prima vista: ad esempio nella stagione fredda le piante perdono le foglie (ma non i sempreverdi e non ai tropici), poi un albero fissa più carbonio da giovane.
L’obiettivo è, direi, capire quanto carbonio può togliere dall’atmosfera un ettaro di bosco attraverso un modello come quelli dell’articolo, approssimato ma tutt’altro che banale. Quanto danno facciamo disboscando e cementificando e d’altra parte quanto è utile riforestare.
Si; si potrebbe aggiungere una stima del genere; un medio-grande albero+il suolo su cui vegeta contiene in media circa 1 ton di carbonio; a regime, al suo climax una foresta è in equilibrio, e non contribuisce; (in effetti sembra che alcune antiche foreste stiano accumulando C nel terreno a causa dello squilibrio causato dal GW) ma ovviamente piantare un nuovo albero in un sistema di alberi (bosco o foresta) potrebbe immagazzinare come ordine di grandezza 1 teragrammo di C ogni milione di alberi; ossia ogni albero al climax immagazzinerebbe 44/12=3.66 ton di CO2; e ogni milione di alberi 3.66 milioni di ton; ogni miliardo di alberi 3.66 Gton di CO2; in Italia ci son circa 12 miliardi di alberi, non so se paragonabili a quelli standard; corrispondenti molto alla raffa a 12*3.66 Gton= 44Gton di CO2 equivalenti immagazzinate nei circa 8-10 milioni di ettari di bosco (1000 x ettaro circa un albero ogni 10mq); 100kg/mq come ordine di grandezza. spero di non sbagliarmi; ricordo sempre più o meno alla grossa che nei primi 20-30 cm di terreno boschivo ci sono alcuni chilogrammi di carbonio per mq;direi fra 5 e 50 per indicare un ordine di grandezza;
importante ricordare che il carbonio è immagazzinato nel sistema albero + suolo; quindi si tratta di conservare o piantare non tanto l’albero come tale ma il sistema ecologico di cui fa parte e consentirgli di arrivare al climax, ossia alla maturità;
altra domanda ma ci vorrebbe un post: a che velocità puo’ accumulare una foresta (10-20kg all’anno per albero)?
in attesa di un post da scrivere ci si puo’ leggere per esempio:
http://www.scienzainrete.it/contenuto/articolo/Le-foreste-%22mangiano%22-davvero-la-CO2, ma non giuro sui numeri che riporta
http://ecoalfabeta.blogosfere.it/2006/12/le-antiche-foreste-assorbono-carbonio-nel-suolo.html
http://downtowngourmetabq.com/2010/11/how-much-carbon-does-a-tropical-tree-sequester/
(domanda ingenua: noi specie umana avremo mai il nostro climax?)
@ Claudio Della Volpe
Giusta l’osservazione che il carbonio è immagazzinato nel sistema albero + suolo, un fatto che spesso viene trascurato.
Mi domando se le sue considerazoini si possono legare all’andamento del CO2 in atmosfera attraverso la curva di Keeling. Ogni dente di sega della curva vale circa 6 ppmv (valore stimato a occhio), quasi 2% del CO2 in atmosfera. D’altra parte ogni dente di sega rappresenta la differenza tra il CO2 fissato dalle foreste dell’emisfero nord e quello fissato dalle foreste dell’emisfero sud. Credo si possa trovare una stima delle foreste nei due emisferi. La differenza di estenzione dei mari nei due emisferi non dovrebbe dare problemi visto che il CO2 fissato dall’acqua marina non dipende dalla stagione almeno in prima approssimazione.
A questo punto però io mi sono perso.
Mi domando se qualcuno ha già fatto considerazioni di questo tipo o se, invece, sono solo perdite di tempo.
@Gianfranco
Sì, qualcuno fa queste considerazioni e le ricerche fervono pure.
Una parte di CO2 è assorbita da plancton alghe ecc – alla base della catena alimentare dei pesci che già se la passano male – non sono perdite di tempo, guardi qui:
https://www.climalteranti.it/2010/07/16/il-gemello-cattivo-del-surriscaldamento-globale/
@ oca sapiens
L’acidificazione dei mari e le sue conseguenza sulla catena alimentare marina mi sta particolarmente a cuore. Infatti ho scritto io l’articolo di climalteranti che lei ha avuto la bontà di citare (grazie).
Poi, come ho detto nello scambio di commenti con Claudio Della Volpe, mi piacerebbe chiudere il cerchio con il carbonio fissato dalla vegetazione attraverso la fotosintesi clorofilliana. L’idea è capire quanto carbonio potremmo togliere dall’atmosfera ri-forestando.
@ oca sapiens
… e se possibile senza ricorrere agli alberi artificiali…
@Gianfranco
Quelle gaffe! come facevo a sapere che siete lo stesso Gianfranco…
Quelli per la carbon capture? almeno crescono dappertutto, potremmo anche mettercene uno in testa…
il respiro della terra, l’oscillazione della curva di mauna loa corrisponde a circa 6 ppmv; esso può essere messo in correlazione con lo sviluppo vegetativo dei due emisferi sia in quantità che in fase, il mare è più costante pare; ora dato che il salto dal periodo pre industriale è dell’ordine di 110 ppmv si tratta di un salto circa 18 volte inferiore; se consideriamo che esso corrisponde al “respiro” di una foresta globale che copre all’incirca un 30% delle terre emerse potremmo fare qualche considerazione:
-la nostra puzzetta che emettiamo con continuità è pari a circa un quarto di questo respiro; dai primi dati di mauna loa nel 1958 valor medio 315ppmv siamo passati a 390; quindi in 52 anni 75 ppmv, circa 1.5 ppmv all’anno, ossia circa un quarto del respiro del pianeta; contiamo per un quarto della foresta globale
-considerare che una foresta, per esempio doppia dell’attuale avrebbe un effetto doppio, ossia una oscillazione di all’incirca 12ppmv;
– ma è ovvio che la domanda importante è quanto carbonio immagazzineremmo in una foresta siffatta posto che si possa realizzarla? dato che abbiamo stimato in circa 50-100 kg/mq la massa di carbonio in una foresta come quella italica e la copertura forestale globale è di circa il 31% della superficie ossia 4×10^13 mq, abbiamo in totale un max di 4×10^15 kg ossia 4000Gton di carbonio al massimo ; ipotizziamo che la foresta globale sia peggio della nostra e riduciamo questa stima del 50% circa otteniamo 2000 Gton di carbonio; facciamo di peggio riduciamola ad un quarto 25kg/mq di foresta solamente, sono pur sempre ben 1000Gton, cioè più di quanto abbiamo accumulato in atmosfera in 250 anni.
anche in questo caso direi che decisamente basterebbe una estensione della foresta dal 31% attuale al 45%, cioè della metà di quella che è oggi per immagazzinare nell’arco di una trentina d’anni la metà di tutto il carbonio in eccesso; direi quindi che la riforestazione è fondamentale per combattere l’effetto serra, ma deve essere di foresta al climax, lasciata lì per il piacere di guardarla diventare grande e bella; ma anche per la vita nostra e dei nostri figli e nipoti; dati recenti si trovano sul sito fao che ha condotto una ampia indagine sulla consistenza delle foreste
http://www.fao.org/forestry/fra/fra2010/en/
PS in aggiunta all’ultimo periodo: sono stato particolarmente pessimista nella stima finale, numericamente basterebbe ben di meno, circa un terzo, ma ci sono ancora molte incertezze sui numeri e preferisco mantenermi largo; scusate.
@ claudio della volpe
Grazie, leggerò le sue considerazioni con calma e con tutta l’attenzione che meritano.
Nel frattempo, se permette, le offro qualche altro elemento di riflessione.
Hansen accenna alla questione nel suo recente libro alle pagine 144 – 147 e giunge a una stima di 600 miliardi di tonnellate di carbonio (GtC) fissate dalle foreste, circa 1 all’anno.
Mi piacerebbe corroborare questa stima con calcoli simili ai suoi.
In ultima analisi vorrei che gli amministratori della mia città, per esempio, sapessero quanto carbonio in meno viene trattenuto dai boschi abbattuti sulla collina che vedo dalla finestra per costruirci villette mentre ampie aree cittadine sono abbandonate al degrado e gli edifici fatiscenti non vengono riqualificati e resi abitabili. E già che ci siamo quanto carbonio in più verrebbe catturato trasformando in bosco parte delle aree industriali dismesse da decenni.
Mi illudo che già sappiano gli altri benefici al microclima urbano in termini di mitigazione delle temperature e abbatimento delle polveri sottili.
[…] vedi anche https://www.climalteranti.it/2011/01/13/qualche-approfondimento-sul-ciclo-del-carbonio/ […]